责编 | 酶美
CD8+ T细胞是杀伤癌细胞的最主要细胞类群。肿瘤浸润T细胞中含有应答肿瘤抗原的T细胞。然而伴随着肿瘤发生过程,这些T细胞经常分化为功能失调状态,即T细胞耗竭。调节肿瘤浸润T细胞的治疗方法已经取得了显著的临床效果,但在不同癌症类型之间差异很大。越来越多的证据显示不同癌症类型的微环境对塑造T细胞的组成和状态发挥着重要作用,但迄今为止仍然缺少对不同癌症类型的T细胞的系统比较。单细胞转录组测序 (scRNA-seq) 已成功应用于精细的表征多种癌症的肿瘤微环境,包括肿瘤浸润T细胞。
2021年12月17日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组联合北京大学肿瘤医院季加孚、步召德课题组以及北京大学第三医院,在Science上发表了题为Pan-Cancer Single Cell Landscape of Tumor-Infiltrating T Cells的研究论文。结合单细胞基因表达谱和 T细胞受体序列,研究者系统刻画了肿瘤浸润性T细胞的异质性和动态性,并系统比较了癌症类型之间的异同。

利用单细胞测序和生物信息技术,研究者之前对三个癌种,即肝癌、非小细胞肺癌和结直肠癌完成了T细胞单细胞水平的研究。为了更好地了解肿瘤浸润T细胞的全貌,了解癌种间的共性和特殊性,本研究收录了更多的癌症类型,包括骨髓瘤、淋巴瘤、肾癌、卵巢癌、子宫内膜癌、食道癌、甲状腺癌、乳腺癌、胃癌和胰腺癌,并广泛收集国际上已发表的类似数据。本研究通过创新生物信息方法,校正混杂因素和批次效应后,有效整合了不同实验平台和实验室来源的数据,从而构建了系统的单细胞水平的泛癌症T细胞图谱,图谱最终涵盖了来自21种癌症类型的316名患者的397,810高质量T细胞数据。
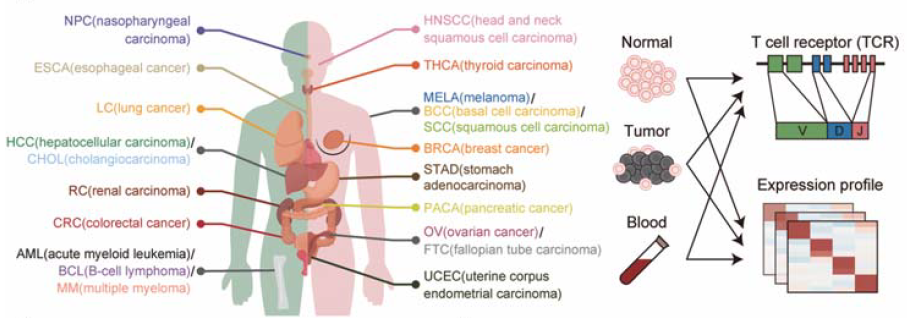
本研究一共识别出17个CD8+T细胞类群和24个CD4+T细胞类群。所有T细胞类群都能在至少80%的癌种中找到。比较癌、癌旁组织和外周血的T细胞组成,可以看到明显的差异。外周血的CD8+T细胞由初始T细胞和终末分化效应T细胞主导。癌旁组织则出现较多的记忆T细胞,而癌组织中出现特有的耗竭T细胞。基于香农熵的多样性指数也定量地表明,从外周血到癌旁组织再到癌组织,T细胞组成的多样性逐渐升高。类似的,CD4+T细胞组分的多样性在癌组织中也最高。在癌组织中丰度最高的CD4+T细胞为TNFRSF9+Treg,且其显著高于在外周血和癌旁组织中。这些结果表明,肿瘤微环境明显地重塑了T细胞的状态。
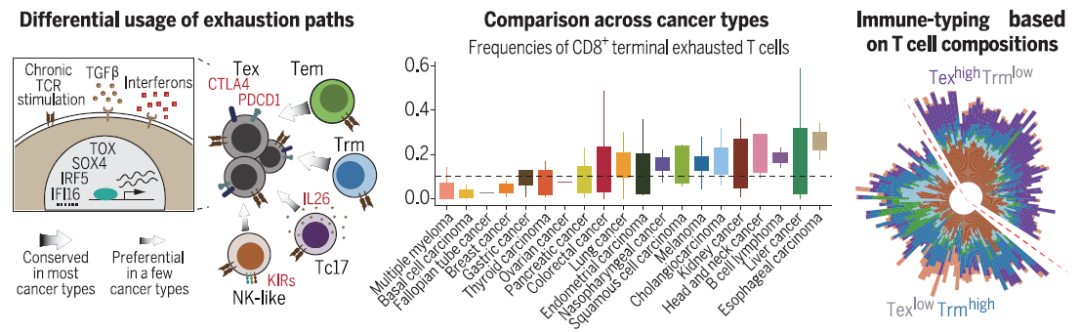
研究揭示了 T 细胞亚群的异质性、分化谱系及其与肿瘤生物学特征的关联。对于 CD8+ T 细胞,研究者分别通过效应记忆T细胞和组织驻留T揭示了T耗竭的两种常见主要途径,以及它们在不同癌症类型中的偏好。研究者还提出了表达干扰素刺激基因的 T 细胞作为 T 细胞耗竭的中间状态。对于 CD4+ T 细胞,研究发现肿瘤中的两种T滤泡辅助细胞,并进一步发现其与肿瘤突变负荷相关,提示了肿瘤细胞如何塑造肿瘤微环境。根据肿瘤浸润T细胞的组成,癌症患者可以分为末期耗竭 CD8+ T 细胞占比高与组织驻留记忆 CD8+ T 细胞占比高的两个组群。基于T细胞的肿瘤免疫分型为理解肿瘤浸润T细胞的总体特性提供了一个参考,也将进一步指导开发新的癌症免疫疗法和病人分层。
T细胞单细胞图谱的主要发现
北京大学前沿交叉学科研究院博士毕业生郑良涛、生命科学学院博士生秦世尚、前沿交叉学科研究院博士后司雯为该论文的并列第一作者,北京大学BIOPIC和生命科学学院张泽民教授、北京大学肿瘤医院季加孚教授和步召德教授、百奥智汇胡学达博士为该论文的共同通讯作者。
郭心怡 (清华大学免疫学研究所董晨团队博士后)
董 晨(中国科学院院士,上海市免疫治疗创新研究院院长,上海交通大学医学院教授,清华大学医学院教授)
近年来,随着癌症免疫疗法的巨大成功和越来越普遍的应用,针对肿瘤微环境及外周循环系统的免疫细胞动态变化及功能研究在世界范围内获得了前所未有的关注和增长。在所有免疫细胞类群中,T细胞无疑是最受瞩目并被广泛研究的细胞群。其中,CD8+ T细胞是杀伤癌细胞的最主要细胞类群,目前多种治疗方法均致力于阻止或逆转毒性T细胞进入被称为“耗竭”的失能状态,从而促进T细胞介导的抗肿瘤过程。单细胞技术的飞跃式发展也使研究人员得以便利地从单个细胞层面解析复杂的肿瘤系统。虽然目前已有不少报道单细胞层面的肿瘤T细胞研究工作,但基本只聚焦在单一或少量癌种上。此外,由于实验技术和分析方法的差异,人们难以对不同癌种的T细胞功能类群做出对应和比较,从而始终无法从宏观的泛癌层面理解肿瘤浸润T细胞群体。
近日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组、北京大学肿瘤医院季加孚课题组及步召德课题组以及北京大学第三医院通力合作在Science上发表了重要工作,通过单细胞转录组和TCR测序技术整合了囊括21个癌症类型、316例病人样本和397,810个T细胞的海量数据,是迄今为止在单细胞水平上规模最大的泛癌种T细胞研究。他们的工作揭示了T细胞不同功能类群在跨癌种间分布的共有特征和特有特征,解析了各类群之间的状态转换关系,并为跨癌种病人的分型提供了以T细胞组成结构为基础的新体系。
有趣的是,他们通过生物信息学方法预测,发现在CD8+ T细胞群体中可能存在多条未耗竭T细胞向耗竭T细胞(exhausted T cell, Tex)的状态转变途径。其中潜在的两条转变途径是多数癌种共有的,包括由效应记忆T细胞(effector memory T cell, Tem)和组织驻留记忆T细胞(tissue-resident memory T cell, Trm)向Tex发展;而其他潜在途径,包括Tc17细胞和类NK态T细胞(NK-like T cell)向Tex的发展过程仅在少数癌种中被观察到。通过深入的通路分析,他们发现除了传统认为的慢性TCR信号刺激外,未耗竭T细胞向Tex的转变过程可能也受到了肿瘤微环境中干扰素 (Interferons) 和TGF-β信号的影响,激活了T细胞耗竭相关转录因子如TOX、SOX4等的表达,从而使T细胞呈现出耗竭表型。通过新的分型系统,他们发现Trm和Tex可能提示了泛癌病人的预后:Trm相对比例高而Tex相对比例低的病人在多个癌种中均被观测到更高的生存率。
在肿瘤微环境中,除了CD8+ T细胞群体常被作为免疫治疗的靶标外,特异地清除调节性T细胞(regulatory T cell, Treg)也长期以来被认为是待攻克的目标和研究的重点,而其中追溯肿瘤浸润Treg究竟是来源于原有的Treg还是其他传统类型的CD4+ T细胞(conventional CD4+ T, Tconv)一直是肿瘤免疫领域的热点和难点。该工作通过追踪带有相同T细胞受体(T cell receptor, TCR)序列的Treg和其他CD4+ T细胞,发现肿瘤中激活态的Treg主要来源于已存在的静息态Treg,但在部分癌种中也观察到了由Tconv转化为Treg的现象,从而为两条转化途径的癌种差异性提供了证据支持。
总而言之,该工作精细地描绘了泛癌T细胞群体的功能和转化图谱,深入解析了CD8+ T细胞耗竭、Treg转化等过程在癌种间的保守性和特异性,提供了新的泛癌分型体系,为肿瘤免疫领域的研究提供了极具价值的数据资源,同时提示了T细胞功能类群与病人预后及免疫治疗效果的相关性。
原文链接:
doi.org/10.1126/science.abe6474