图1:参与该研究的部分人员合影
1 研究概况
癌症免疫疗法成为近些年最为关注的领域之一,制药巨头也砸下重金,却难以避免大面积的临床试验失败。肿瘤微环境中具有多种不同类型的免疫细胞,它们具有怎样的特性和相互作用,这些基础性问题还亟待解答。北京大学张泽民教授表示,必须重视基础研究,它可以为免疫治疗提供指导性思路。
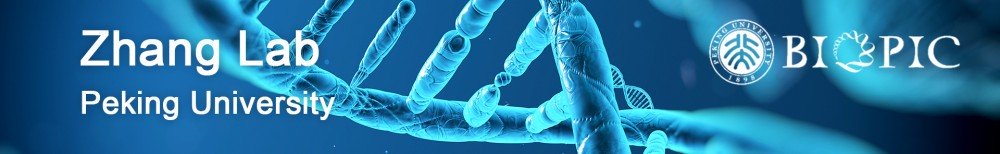
北京大学张泽民实验室在肿瘤T细胞单细胞研究方面拥有国际领先水平,曾于2017年和今年6月分别在《Cell》和《Nature Medicine》发表肝癌和肺癌大规模免疫图谱,距上次发文仅4个月时间,研究团队于今晨在《Nature》发表题为“Lineage tracking reveals dynamic relationships of T cells in colorectal cancer”的结直肠癌T细胞研究成果,为免疫治疗提供了新的指导性思路。基因慧独家专访如下。
2 研究成果
- 生物信息追踪方法 STARTRAC
- 发现新的靶点成为可能
- 大量单细胞水平的TCR数据
【基因慧】张教授您好,恭喜您和团队再次发表新成果,短短一年多时间,相继在顶级学术期刊《Cell》、 《Nature Medicine》发文,分别绘制了肝癌和肺癌T细胞单细胞免疫图谱,今天发表的则是针对结直肠癌,您能通俗地向读者谈谈这项成果的发现和意义吗?
【张泽民教授】非常感谢基因慧对我们工作的关注。科学发展是连续的,我们前期肝癌和肺癌T细胞的工作为我们今天结直肠癌的成果奠定了坚实的基础,而同时也对我们探索更新的科学发现提出了挑战。团队从项目伊始就围绕结直肠癌病人异质性与T细胞的关系,开发新的生物信息学分析方法,并同合作方一道挖掘新的可能作为靶点的分子。很幸运的是,我们在以上几个方面都取得了国际领先的创新成果,这与团队成员的努力密不可分。下面请我们团队的核心人物,一作张雷博士,为读者解答这个问题。
【张雷博士】(共同一作)在本项研究中,我们对12例结直肠癌患者的大量T细胞展开了单细胞全长转录组研究。在前期工作的基础上,我们开发了基于单细胞TCR的生物信息追踪方法 (STARTRAC),深入阐释了结直肠癌T细胞多种特性,如组织分布特性、克隆性、迁移性和状态变化特性,这是国际上迄今为止对结直肠癌或者说肿瘤微环境中T细胞最为全面新颖的单细胞组学研究,也使我们针对不同基因型结直肠癌病人比较,新的靶点基因的发现成为可能。
我们知道,2017年NCCN指南已经将PD-1单抗pembrolizumab(Keytruda)和nivolumab (Opdivo)推荐用于具有基因组微卫星不稳定(MSI)的晚期结直肠癌患者的末线治疗,但是PD-1单抗靶向的T细胞的特征在基因组微卫星稳定性与否的患者之间仍有待深入研究。我们在本项目中从单细胞组学这一高精度和全面性的维度对其给出了比较分析,得到MSI病人中显著富集的一类TH1-like细胞,并挖掘验证了这类细胞上特异表达的一个新的分子,为推广已有免疫治疗方案到更多患者提供了理论依据。
本研究组于2017年发表于《Cell》的肝癌T细胞研究,以及2018年发表于《Nature Medicine》的非小细胞肺癌T细胞研究。我们也将结直肠癌的T细胞数据与这两种癌症 T细胞数据进行了比较,分析它们的异同,从而解释肿瘤免疫在不同癌种的差异。
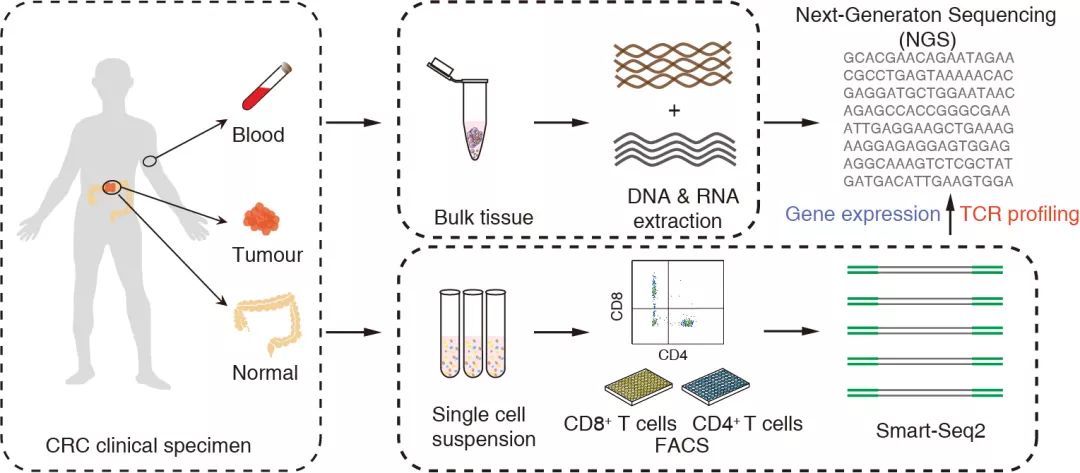
【基因慧】研究发现肿瘤浸润调节T细胞(Treg)表现出高度扩张的特征,还发现CD4+细胞总体上表现出较低的克隆扩增性,能否简单介绍一下研究中出现的不同类T细胞,以及其主要特征和作用。
【郑良涛】(共同一作)我们通过TCR的分析和增殖相关基因的分析看到,
T细胞群的克隆扩增性较低。但是也有几个CD4+T细胞群有显著高的扩张特性,包括肿瘤里的Treg,两群高表达IFNG的类Th1细胞和肿瘤里的Th17。再加上肿瘤的CD8+耗竭细胞,这些细胞群体非常可能是对肿瘤抗原有反应的T细胞,这些响应肿瘤抗原的细胞群有着很不一样的功能。
CD8+耗竭细胞应该是有抗肿瘤作用的T细胞,它们高表达了大量的抑制性受体,如PDCD1、CTLA4、HAVCR2等,同时又表达大量的细胞毒性相关基因,特别是GZMB、IFNG。此外,还有CXCL13基因的表达,意味着除了直接的毒性杀伤作用外,还可能通过促进肿瘤内的滤泡结构形成,并招募B细胞来发挥抗肿瘤作用。CD8+耗竭细胞的这些功能和特性在最近的其他几个研究里也有报道。T细胞耗竭也是一个容易引起混淆的概念。我们和其他一些免疫学家如John Wherry认为,我们看到的CD8+耗竭细胞在“当下”是有很高的毒性基因表达、呈高增殖状态。
和其他研究相比较,我们的一个优势是有大量单细胞水平的TCR数据。通过基于信息熵的状态转移指数,我们发现CD8+耗竭T细胞和肿瘤内一群高表达GZMK,而低表达HAVCR2的记忆T细胞有显著的状态转移关系。这群细胞也是我们在之前的肺癌研究里说的“前耗竭”细胞类群之一。这群记忆T细胞和一群以CX3CR1为标记的CD8+毒性效应T细胞也有显著的状态转移关系。进一步我们发现,肿瘤里的记忆T细胞和血液里的CD8+毒性效应T细胞之间的TCR共享,肿瘤里的记忆T细胞和肿瘤里的CD8+耗竭细胞之间的TCR共享,两者是显著互斥的。这意味着TCR可能决定了细胞分化为毒性效应T细胞或者CD8+耗竭细胞。
肿瘤里有两群高表达IFNG的CD4+T细胞,即类Th1细胞,这两群细胞(即CD4-C07-GZMK和CD4-C09-CXCL13)间有关键转录因子的差异表达,包括EOMES、RUNX3,特别是BHLHE40。其中高表达BHLHE40的类Th1细胞也表达了CXCL13和IGFLR1。后者我们通过功能实验,认为具有T细胞共激活受体性质。这两群类Th1细胞之间也有较高的状态转移指数,意味着它们之间具有分化关系。值得注意的是,相比MSS病人,只有CXCL13高表达且BHLHE40高表达的这群类Th1细胞在MSI结直肠癌里有更多的富集,因此这群类Th1细胞可能使得MSI结直肠癌有更好的免疫治疗响应。
其他类的T细胞还包括从初始T细胞到不同分化终端的T细胞,如富集在正常肠粘膜里的Tfh、内皮T淋巴细胞(IEL)等。
图3:结直肠癌患者T细胞主要类群及其特征
3 产、学、研、医合作
- Wenjun Ouyang博士带领Amgen团队
- 北大人民医院提供样本和临床病理资料
【基因慧】跟此前研究一样,本次的研究团队也采取研究院、医院和药企合作的方式,包括北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心、北大生命科学学院、美国药企Amgen,以及北京大学人民医院,他们分别在研究中贡献了哪些力量呢?
【张泽民教授】我的团队里的博士后、博士生和其他科研人员隶属于北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心、北大生命科学学院,主要负责试验设计、样本处理、单细胞实验、生物信息方法设计、应用和分析。Wenjun Ouyang博士带领的Amgen团队在科学思路、数据理解、重要基因的功能实验分析等方面有重要贡献。来自北京大学人民医院的申占龙教授课题组为研究提供了极其珍贵的样本和临床病理资料,也协助了数据有效临床解读。整个研究是在多个团队的精诚合作下才得以完成的。
4 技术创新与突破
- STARTRAC的主要指数是基于信息熵
- 全新使用迁移指数和状态转移指数
- 定量刻画不同细胞群特性
【基因慧】研究中获取了12例结直肠癌患者的11,138个T细胞,通过自主开发的分析工具“STARTRAC分析”来定量分析T细胞亚群间的关系,能否简单介绍一下这项技术的创新之处与设计思路?对于样本数量是否有个体差异的限制?
【任仙文博士】(团队信息负责人)STARTRAC的主要指数都是基于信息熵,主要包括扩增指数、迁移指数和状态转化指数。这使人容易想到另一个在整块组织TCR测序数据分析里常用的克隆指数。STARTRAC的扩增指数和常用的克隆指数在数学公式上是一致的,然而两者有明显的不同。前者是细胞群水平的,后者是整个组织水平的。一个样本里往往会有多个不同的细胞群,STARTRAC的扩增指数是定量这样的每个细胞群的克隆扩增属性;而常用的克隆指数只是定义所有细胞作为整体的克隆扩增属性。也可以认为STARTRAC的扩增指数是常用克隆扩增指数在单细胞数据里的推广应用。
迁移指数和状态转移指数则是本研究里全新使用的。两者是基于我们认为,属于相同的TCR克隆型(clonotype)的T细胞,即便它们出现在不同的组织里或者处于不同的分化状态,逻辑上它们应该都是来自于同一个初始T细胞,其在一个地方进行克隆扩增然后迁移到其它组织或者分化到其他状态。我们从单细胞数据里可以得到同一克隆型的T细胞在不同组织或不同状态里的相对频率分布,进而通过信息熵整合成克隆型的迁移指数或状态转化指数,再把一个细胞群(如CD8+耗竭T细胞)里的所有克隆型的指数进行加权平均,得到这个细胞群的指数。STARTRAC的指数使得我们可以更定量、更方便的刻画、比较不同细胞群的特性。
STARTRAC的指数对细胞数没有明确的要求。当然如果有更多的细胞,可以得到更准确的定量分析结果和结论。
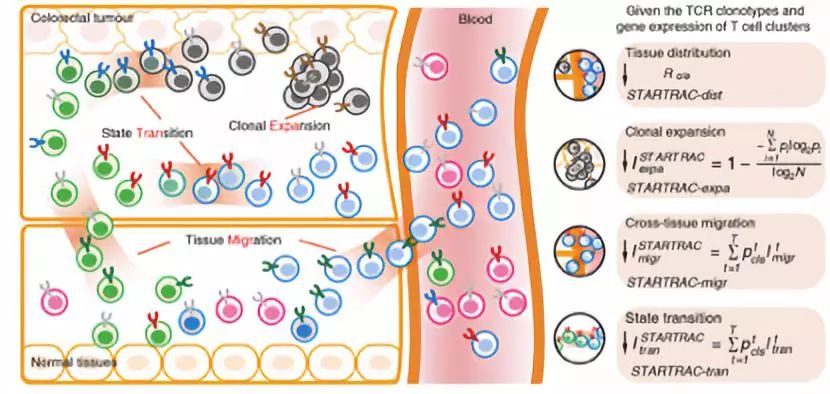
图4:STARTRAC图示
5 肝癌、肺癌与结直肠癌研究的差异
- 大量T细胞深度单细胞测序
- 比较MSI和MSS类型的结直肠癌
- 不同类肿瘤浸润的T细胞有很大差异
【基因慧】相比此前研究的肺癌和肝癌,结直肠癌的T细胞单细胞免疫图谱的研究有哪些不同和借鉴之处呢?
【张园园】(共同一作)这三个研究在总体思路上采用了相同的策略,即对癌症患者的大量T细胞进行深度单细胞测序,然后整合基因表达和TCR的信息进行深入分析。相比而言,结直肠癌T细胞的研究有不同的特点。
首先,微卫星不稳定(MSI)的结直肠癌对免疫治疗的响应显著高于微卫星稳定(MSS)的结直肠癌。因此,我们在最初项目设计的时候就决定收集这两种不同类型的结直肠癌。MSI的结直肠癌在结直肠癌中的比例比较少,据统计不超过15%。我们最终总共收集到4个属于MSI类型的结直肠癌。
其次,在进行这一系列研究的过程中,我们对肿瘤免疫的认识在不断深入,对单细胞数据的理解也不断深入。我们提出了采用基于信息熵的指数STARTRAC来定量的刻画细胞群的扩增、迁移、状态转换等方面的特性。STARTRAC可以应用到其他类似的研究中。
再次,由于三个研究的实验流程、基本数据处理流程都是一样的,批次效应不明显,我们把肝癌、肺癌和结直肠癌的T细胞单细胞数据合并到一起,作了比较分析。从分析结果我们看到组织类型也对肿瘤内的T细胞组成有塑造作用,不同的肿瘤类型,其浸润的T细胞也有很大差异。这提示我们,我们对肿瘤浸润T细胞的研究远远不够。我们后续也还将进行更多深入研究。
最后,三个研究给我们启示,项目设计的时候需要针对有重大意义的临床问题,如结直肠癌T细胞的研究中,比较MSI和MSS类型的结直肠癌就是一个很好的例子,这也是我们觉得可以借鉴的地方之一。比如,开展新的研究课题可以考虑比较患者在免疫治疗前、免疫治疗后的免疫细胞。
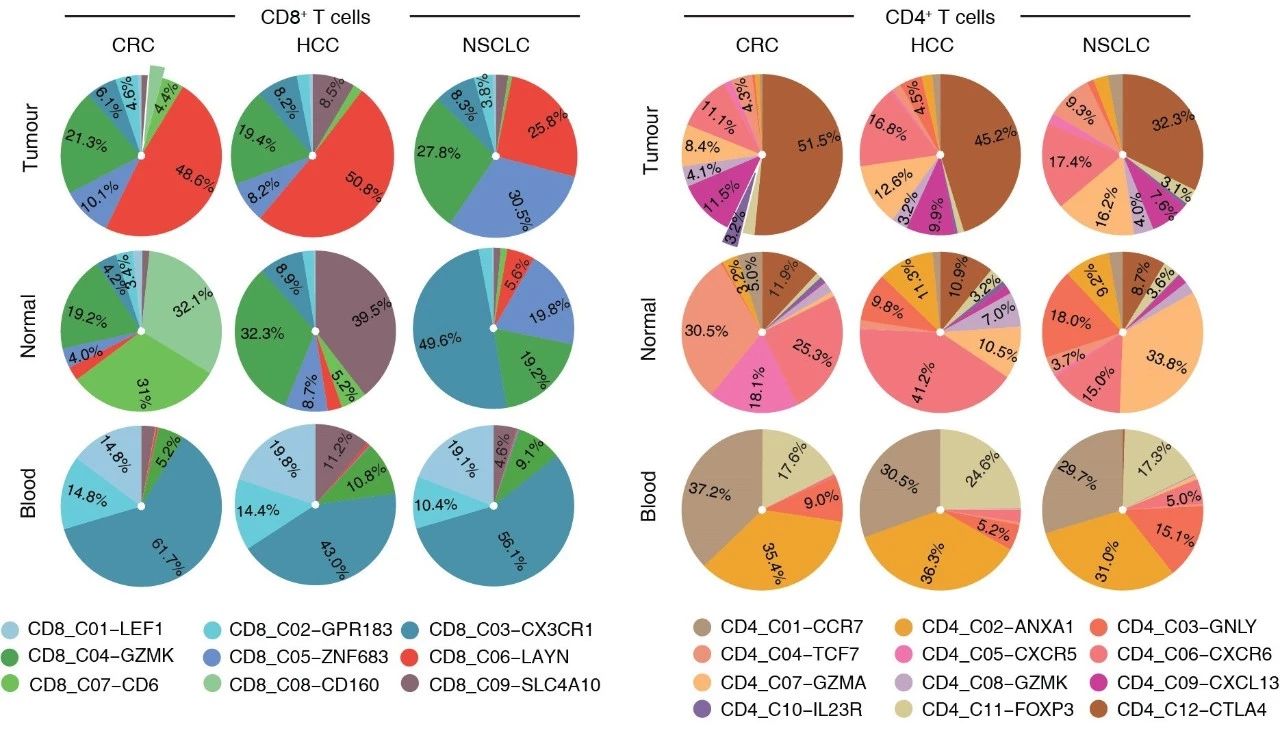
图5:三种肿瘤的T细胞组成存在明显差异
6 发现潜在免疫治疗标志物
- CXCL13+BHLHE40+类TH1细胞
- 需临床数据和基础研究进一步验证
【基因慧】此次研究发现,MSI癌症患者中如果CXCL13+BHLHE40+类TH1细胞富集,可能这些患者会对免疫疗法产生积极响应,这是否属于新发现的标志物,将对癌症患者治疗产生怎样的帮助?未来如果落地临床,还需要进行哪些工作呢?
【胡学达博士】(团队实验负责人)此前有研究报道,MSI的结直肠癌里有更多的IFNG+类Th1细胞。而我们现在的研究发现,肿瘤里有两群非常不同但有状态转化关系的IFNG+类Th1细胞,其中只有CXCL13+BHLHE40+类TH1细胞在MSI肿瘤里富集。我们进一步分析了这群细胞的分子特征,发现其高表达IGFLR1。我们的功能实验表明IGFLR1具备共激活受体特性。我们也在大样本的TCGA数据里,发现MSI的结直肠癌表达更高的CXCL13+BHLHE40+类TH1细胞的特征基因。这些发现让我们相信,CXCL13+BHLHE40+类TH1细胞是潜在的结直肠癌免疫治疗标志物。不过,我们还需要临床数据来验证其是否能作为标志物。
如果后续研究证实CXCL13+BHLHE40+类TH1细胞可以作为免疫治疗响应的标志物,那么检测这群细胞在肿瘤里的含量将对预判患者的响应、是否及如何使用免疫治疗具有重要指导作用,针对CXCL13+BHLHE40+类TH1细胞研发更多药物也将给患者带来希望。
要落地临床,还有很多的工作要做。如要有临床试验来验证CXCL13+BHLHE40+类TH1细胞的标志物价值,要有更便捷、准确、经济的方法来检测这群细胞的含量。另外,许多针对CXCL13+BHLHE40+类TH1细胞的基础研究也得马上进行,如体外、体内试验来阐释这群细胞对抗肿瘤的作用,和肿瘤微环境中其他组分的关系,这群细胞的一些关键基因的调控关系,以及如何使得肿瘤内有更多的这群细胞的浸润,并且阻断其受抑制、避免其进入衰竭状态。
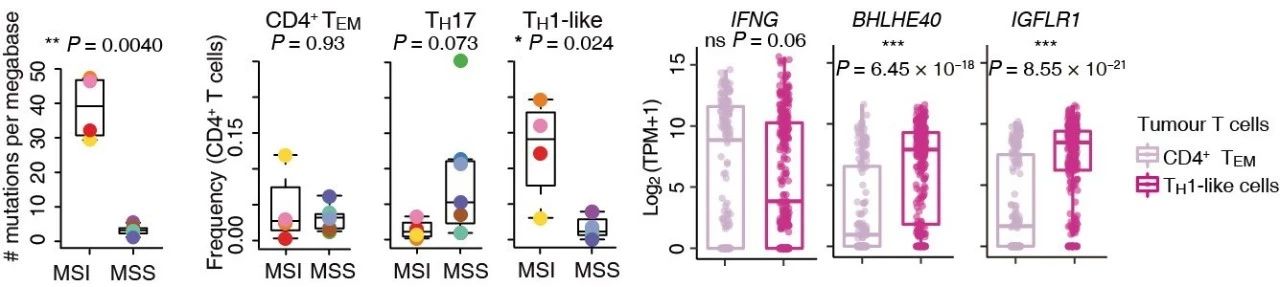
图6:比较MSI和MSS结直肠癌
7 基础研究为免疫疗法带来指导
- 缺乏对生物标志物的系统评价
- 理解生物标志物的分子机制
- 肿瘤免疫大跃进
- 基础研究有助降低临床试验风险
【基因慧】目前在研的免疫治疗生物标志物有很多种,包括MSI、TMB、PD-L1等,您如何评价这些标志物的应用前景?如何更好地去评估这些生物标志物?
【张泽民教授】我们见证了免疫检验点抑制剂等免疫治疗在多种癌症上的成功,也看到了其在不同癌种或同一癌种的不同患者间巨大的疗效差异。近年来临床和机制研究贡献了大量潜在的评估其疗效的生物标志物,但问题仍然很多。
第一个主要问题是缺乏对生物标志物的系统评价,它们之间的内在联系和相互决定等需也需要定量,这就要求高质量的队列和组学的研究手段。
第二个主要问题是需要理解生物标志物的分子机制,如MSI患者对PD-1治疗响应较好,但MSI肿瘤细胞是如何塑造和选择肿瘤微环境中的免疫细胞,特别是T细胞组分和状态的,一直没有精细的刻画,而这恰恰是本项研究的主要关注点。我们实验室希望并致力于发现更具临床应用价值的生物标志物或标志物组合早日让更多癌症患者获益。
【张泽民教授】目前在临床试验中大概有几千种涉及免疫治疗的联合治疗,这是肯定了免疫治疗的广阔前景。但是实际上很多组合并没有很强的机制上的依据,几乎是蜂拥而上,造成了目前的“肿瘤免疫大跃进”。虽然肯定会有些联合治疗脱颖而出,然而大部分会以失败告终。基于临床试验耗资极大的现状,这些失败给很多公司和投资者带来了巨大风险。
我认为还是要强调肿瘤免疫的基础研究,对相关细胞的亚型特点、生化通路、和调节因子有深入了解,在这个基础上再科学地判断联合治疗的理论基础和可行性。只有这样才能大幅度降低联合治疗的临床试验风险。我们就是基于这方面考虑才非常深入地研究肿瘤微环境的基本特征,为免疫治疗联合疗法带来指导性的思路。