2022年9月23日,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组在国际期刊Nature Cancer上发表了题为Single-cell meta-analyses reveal responses of tumor-reactive CXCL13+ T cells to immune-checkpoint blockade的研究论文,通过对公共数据集的分析,该研究提出了基于CXCL13表达水平识别免疫检查点阻断(ICB)治疗前后肿瘤微环境中肿瘤抗原特异T细胞的方法,鉴定了肿瘤特异CD8+ T细胞的不同分化状态及其特征,并从多癌种水平揭示了ICB在细胞层面上的作用机制。

鉴定肿瘤微环境中肿瘤抗原特异CD8+ T细胞的特征及其分化状态是理解肿瘤免疫治疗机制的关键。最近相关文章[1,2]在单细胞水平上鉴定了未经治疗(treatment-naive)肿瘤中肿瘤抗原特异T细胞以及bystander(非肿瘤特异性T细胞)的特征与区别,发现肿瘤中的肿瘤抗原特异T细胞会上调以PD-1、CTLA4、LAG3、TIGIT为代表的共抑制性受体。相应地,这些共抑制性受体以及CD39等T细胞耗竭(exhaustion)相关基因可以准确地鉴定treatment-naïve肿瘤中的肿瘤抗原特异T细胞。但是在ICB治疗过程中,张泽民课题组之前的研究[3]以及其他相关研究[4]发现肿瘤抗原特异T细胞在治疗的作用下可以维持在未耗竭的前体细胞的状态,因此如何有效地准确鉴定ICB治疗前后(1)终末分化且耗竭程度高的肿瘤特异T细胞以及(2)耗竭程度低的肿瘤特异T细胞前体细胞仍然是一个难题。
通过分析包含CD8+ T细胞基因表达以及对应抗原特异性信息的公共单细胞数据集,并结合发表的具有治疗前后配对的肿瘤浸润CD8+ T细胞数据集,该研究发现CXCL13的表达既可以准确鉴定终末分化且耗竭程度高的肿瘤特异T细胞克隆,也可以鉴定ICB治疗后有响应肿瘤中大量出现的耗竭程度低的肿瘤特异T细胞前体细胞克隆(图1)。
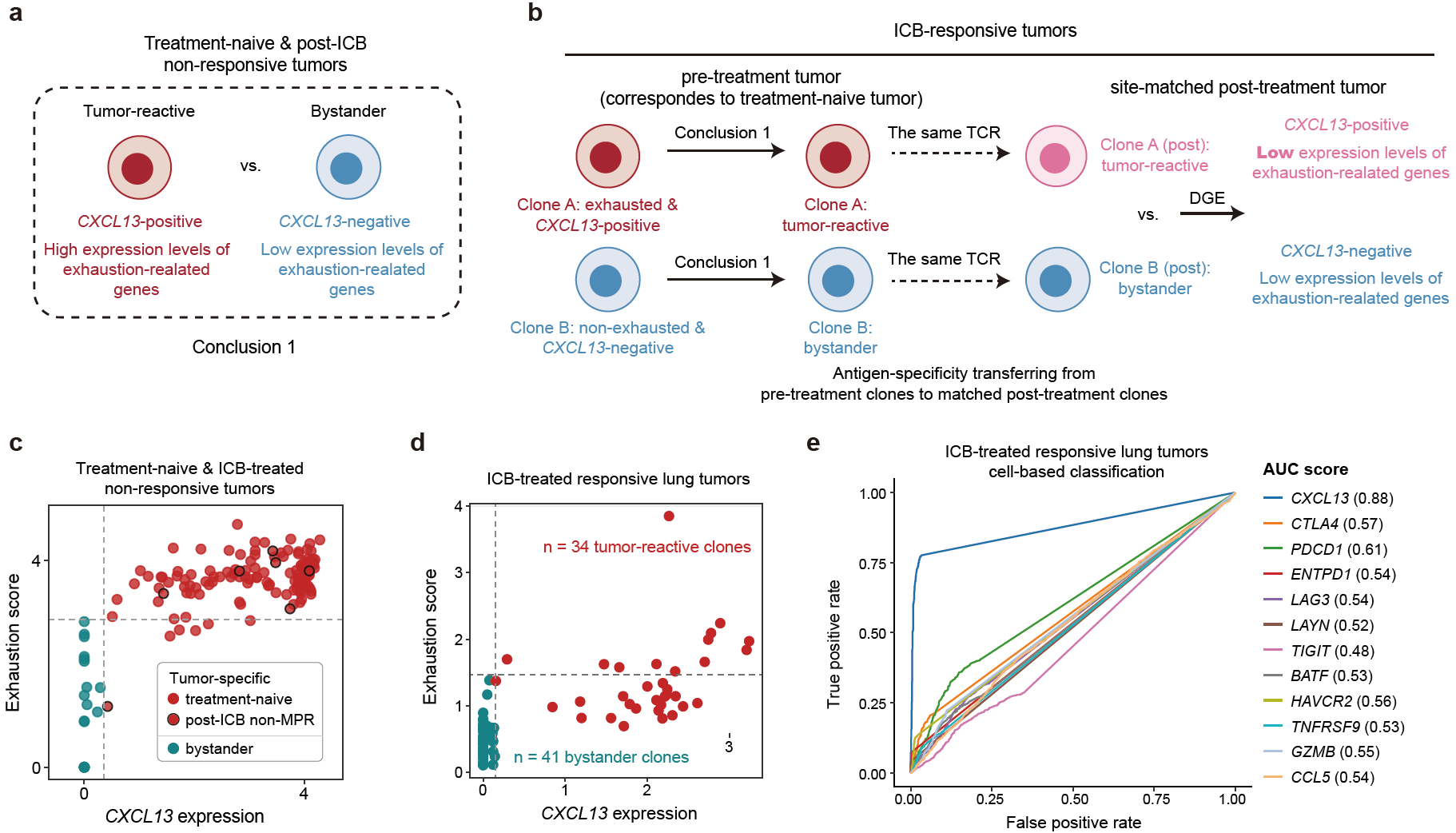
图1 CXCL13鉴定ICB治疗前后肿瘤中不同分化状态的肿瘤特异CD8 T细胞
为了探究ICB在多癌种上对肿瘤特异CD8+ T细胞的作用机制,研究人员收集了已发表的9个免疫治疗单细胞数据集,包括来自102个病人治疗前后的205个肿瘤样本,涵盖5种癌症类型(NSCLC, BCC, SCC, breast cancer & RCC)。研究人员基于CXCL13表达量鉴定这些数据集中的肿瘤特异CD8+ T细胞,发现肿瘤特异性CXCL13+CD8+ T细胞显著富集在对ICB有响应的肿瘤中,并且在有效地治疗后显著增加(图2),表明了肿瘤特异性CXCL13+CD8+ T细胞在治疗过程中发挥关键作用,且在治疗前的浸润程度可以预测ICB的疗效。
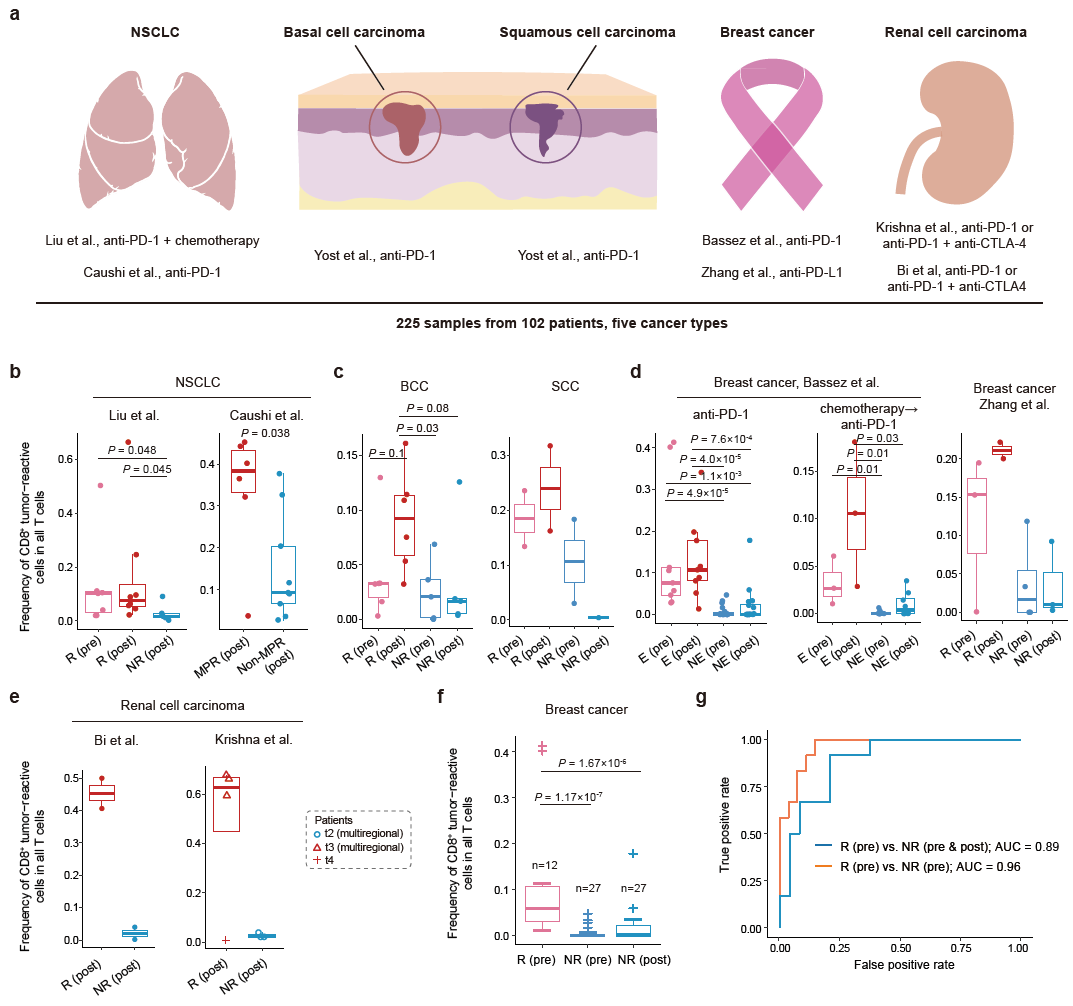
图2 ICB治疗前后肿瘤特异性CXCL13+CD8+ T细胞变化
之前对于基底细胞癌(BCC)和乳腺癌的研究[5,6]发现ICB有效治疗后终末分化且耗竭程度高的肿瘤特异T细胞显著增加。而在肺癌的研究中,张泽民课题组之前的研究[4]发现有效的ICB治疗增加了耗竭程度低的肿瘤特异T细胞前体细胞。肿瘤特异T细胞前体细胞具有更强的增殖能力和整体上更强的抗肿瘤功能[7];而终末分化的肿瘤特异T细胞随着耗竭程度变强虽然功能有下降,但是这群细胞仍然能够杀伤癌细胞[8,9],并且,在treatment-naïve肿瘤中由于前体细胞数量很少[2],终末分化的肿瘤特异CD8+ T细胞是主要杀伤癌细胞的CD8 T细胞类群。此外,研究表明ICB会进一步增加终末分化的肿瘤特异CD8+ T细胞的杀伤能力[10],因此在不同癌症类型中观察到ICB有效治疗后显著增加的(1)终末分化且耗竭信号较强的肿瘤特异T细胞或(2)耗竭程度低的肿瘤特异T细胞前体细胞都可以有效杀伤癌细胞并引起肿瘤的减小。
为了进一步探究这一现象,研究人员对肿瘤特异性CXCL13+CD8+ T细胞进行聚类分析,鉴定了前体肿瘤特异性CXCL13+CD8+ T细胞(包括IL7R+HAVCR2– 以及GZMK+HAVCR2–两个亚型)以及耗竭信号较强的终末分化肿瘤特异T细胞,并且发现肿瘤特异性CXCL13+CD8+ T细胞不同分化状态亚型在表观特征上是稳定的(图3)。研究人员发现在不同癌症类型中以及治疗策略不同时(例如是否与化疗联用),治疗引起增加的肿瘤特异T细胞的亚类是不一样的。当肿瘤微环境整体免疫抑制强度较高时,ICB不足以维持前体肿瘤特异性CXCL13+CD8+ T细胞的状态,观察到终末分化的肿瘤特异T细胞增加,但治疗仍然有效。当肿瘤微环境整体免疫抑制强度较低时,ICB有效阻断了肿瘤特异性CXCL13+CD8+ T细胞前体细胞向耗竭程度较高的终末状态的分化(图3)。
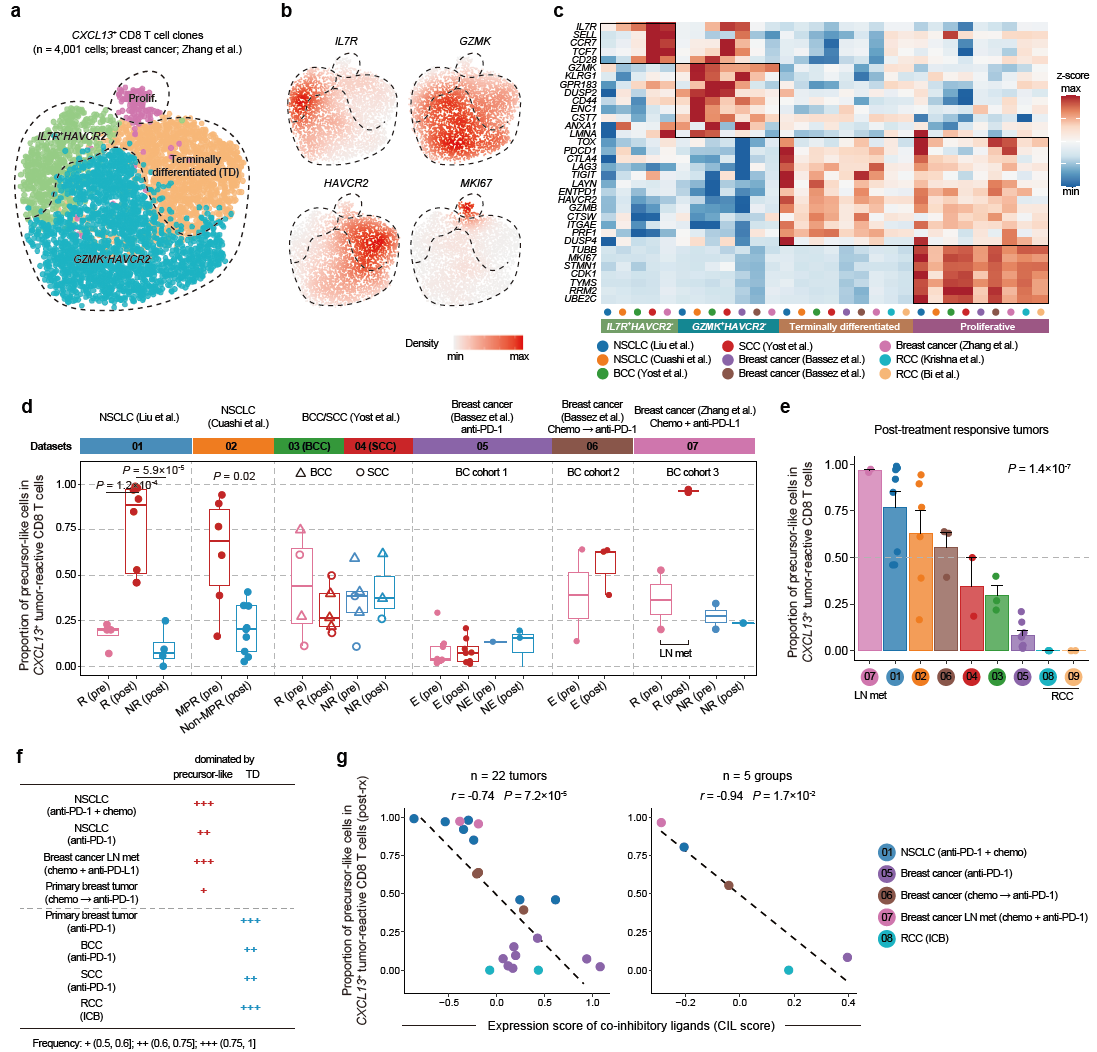
图3 CXCL13+ CD8+ T细胞亚型与ICB治疗关系
在CD4+ T细胞中,ICB显著地增加了CXCL13+CD4+ T细胞(图4),表明了该类群是CD4 T细胞中对ICB响应的主要类群,这与最近相关研究发现CXCL13+CD4+ T细胞能够识别并处理肿瘤抗原特异一致[11]。此外,研究发现同时检测肿瘤中CXCL13+CD4+ T和CXCL13+CD8+ T细胞类群的比例可以更准确地预测ICB的疗效,在多个癌症类型中的预测准确率>90%(图4),性能显著高于传统的标志物TMB。
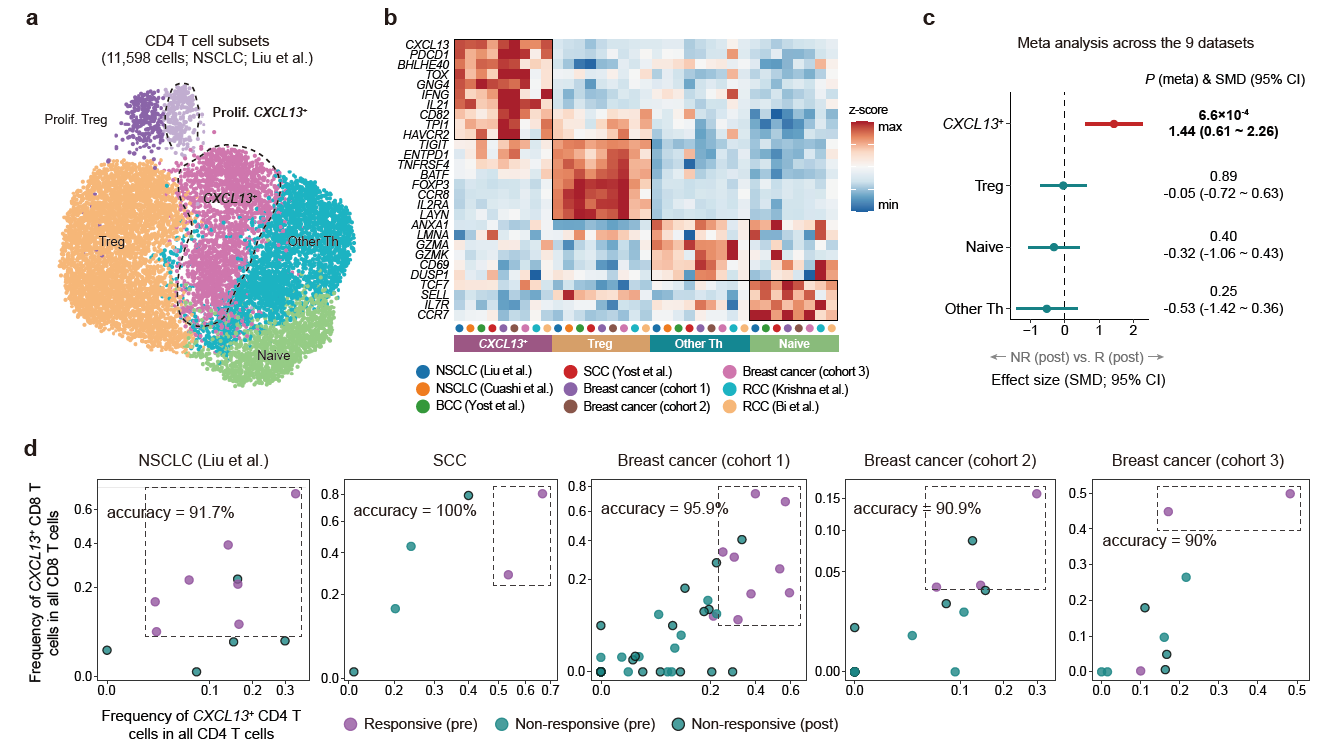
图4 CXCL13+ CD4+ T细胞与免疫治疗
该研究的科学发现(1)为分析肿瘤中的肿瘤特异T细胞提供了新的思路;(2)为预测ICB疗效提供了准确的生物标志物;(3)为设计以TCR-T为代表的细胞疗法提供了新的策略,即通过CXCL13表达水平鉴定肿瘤中不同分化阶段的肿瘤特异T细胞克隆并设计后续临床试验;(4)为进一步提高ICB疗效提供了新的见解,即通过ICB与其他疗法联合治疗进一步缓解肿瘤微环境中的免疫抑制强度,维持前体肿瘤特异性CXCL13+CD8+ T细胞状态并阻断其向终末状态分化,进而继续提高治疗效果。
北大BIOPIC/生命科学学院博士生刘宝琳为该论文的第一作者,张泽民实验室张园园博士、王东方博士以及百奥智汇胡学达博士为该论文做出了重要贡献。北京大学BIOPIC/生命科学学院张泽民教授为该论文的通讯作者。该研究得到北京市科委、国家自然科学基金、国家重点研发计划、ICG、和昌平实验室的支持和资助。
论文链接:
https://www.nature.com/articles/s43018-022-00433-7
对应Commentary文章:
https://www.nature.com/articles/s43018-022-00432-8
参考文献:
[1] Lowery, F. J. et al. Molecular signatures of antitumor neoantigen-reactive T cells from metastatic human cancers. Science (2022).
[2] Oliveira et al., Phenotype, specificity and avidity of antitumour CD8+ T cells in melanoma, Nature (2021).
[3] Liu et al. Temporal single-cell tracing reveals clonal revival and expansion of precursor exhausted T cells during anti-PD-1 therapy in lung cancer. Nat. Cancer (2022).
[4] Caushi et al., Transcriptional programs of neoantigen-specific TIL in anti-PD-1-treated lung cancers, Nature (2021).
[5] Yost, K. E. et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nat. Med. (2019).
[6] Bassez, A. et al. A single-cell map of intratumoral changes during anti-PD1 treatment of patients with breast cancer. Nat. Med. (2021).
[7] Eberhardt, C. S. et al. Functional HPV-specific PD-1+ stem-like CD8 T cells in head and neck cancer. Nature (2021).
[8] Thommen, D. S. et al. A transcriptionally and functionally distinct PD-1+ CD8+ T cell pool with predictive potential in non-small-cell lung cancer treated with PD-1 blockade. Nat. Med. (2018).
[9] Duhen, T. et al. Co-expression of CD39 and CD103 identifies tumor-reactive CD8 T cells in human solid tumors. Nat. Commun. (2018).
[10] Clarke, J. et al. Single-cell transcriptomic analysis of tissue-resident memory T cells in human lung cancer. J. Exp. Med. (2019).
[11] Zheng, C. et al. Transcriptomic profiles of neoantigen-reactive T cells in human gastrointestinal cancers. Cancer Cell (2022).