淋巴细胞在肿瘤免疫和免疫治疗中有着核心作用。肿瘤通过多种机制抑制自身免疫系统对肿瘤的清除。在部分病肿瘤中有一定程度的T细胞浸润,因为肿瘤仍然存在,这些肿瘤中的T细胞的功能必定是受限的。肿瘤浸润淋巴细胞在细胞类型、基因表达和功能特性方面具有着高度异质性。这些异质性不仅反应了肿瘤免疫抑制的不同机制,同时也影响了肿瘤免疫治疗的效果。
免疫检查点抑制剂治疗改变了多种肿瘤的治疗前景。尽管部分病人对免疫检查点抑制剂治疗有很好响应,在有响应的病人中,通过产生肿瘤特异性记忆T细胞反应,病人长期生存效果很好。病人对免疫检查点抑制剂治疗的响应与治疗前肿瘤浸润T细胞相关。在结肠癌中,相较于微卫星稳定(Microsatellite stable,MSS)的病人而言,基因组微卫星不稳定(Microsatellite-instable,MSI)的病人响应免疫检查点抑制剂治疗要好,然而具体机制未知。因此,深度阐释结直肠癌T细胞特性,了解两类病人间T细胞的特征差异,特别是对其在肿瘤微环境中动态变化的刻画,可为人们进一步发掘新的治疗靶点和策略提供契机。
10月29日,北京大学张泽民课题组联合美国Amgen欧阳文军团队和北京大学人民医院申占龙课题组在Nature杂志发表了题为Lineage tracking reveals dynamic relationships of T cells in colorectal cancer的研究论文。该项工作在国际上首次开发了STARTRAC (Single T-cell Analysis by Rna-seq and Tcr TRACking)生物信息分析方法,对在12位结肠癌病人中获取的11,138个单个T细胞的组织分布特性、克隆性、迁移性和状态变化特性进行了系统性地定量刻画,是目前对肿瘤浸润T细胞最新颖最深入的研究。特别指出的是,本研究首次发现了基因组微卫星不稳定(Microsatellite instable,MSI)和微卫星稳定(Microsatellite stable,MSS)病人间差异的新类群,并阐释了类群特异表达的协同刺激因子的功能。此项国际领先的开创性工作,可为人们研究其他疾病中的T细胞以及开发新的治疗方案提供思路。

T细胞受体(T-cell receptor, TCR)与MHC-抗原肽复合物结合,从而决定了T细胞对抗原的反应,在T细胞活化和功能中起核心作用。T细胞表面表达的TCR由α链和β链组成。TCR在T细胞发育过程中经历V(D)J重排,形成了机体TCR的多样性。因此TCR序列可以用来作为T细胞谱系示踪的标志。
这些来自12位结肠癌病人的11138个T细胞测序结果经过质量控制过滤之后得到的10805个细胞序列(图1),其中91.4%的T细胞具有至少一对全长的TCR α和β链序列。对这些TCR序列分析,共有7274个克隆型,即独特的α-β双链。其中870个克隆型对应两个或两个以上T细胞,即这些3474个T细胞经历了克隆性扩增。共8个CD8+ T细胞和12个CD4+ T细胞亚群被鉴定出来。
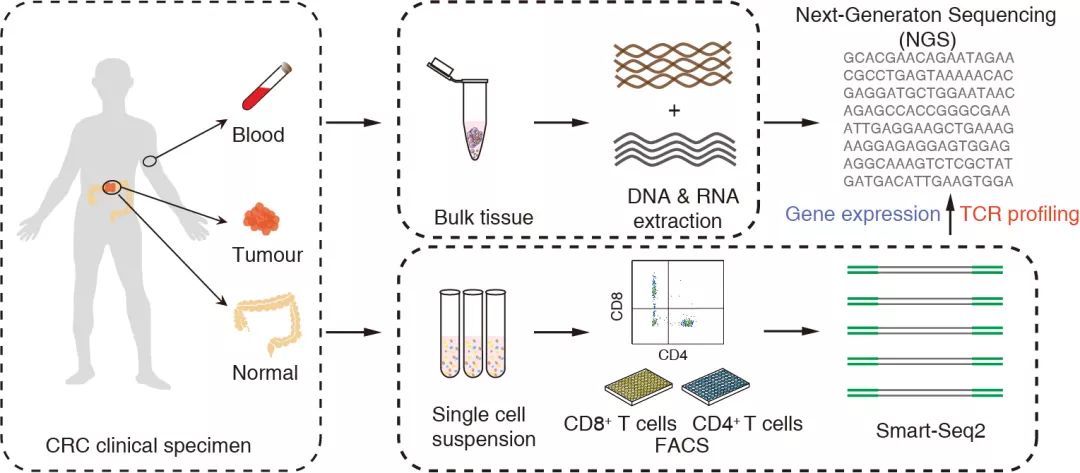
图1. 结直肠癌T细胞数据获取流程
作者研究了不同亚群的组织分布。CD8+ T细胞中,初始T细胞(Naïve T cells, TN)、中央记忆T细胞(Central memory T cells, TCM)和效应T细胞(Recently activated effector memory or effector T cells, TEMRA)主要分布在外周血。耗竭性T细胞(exhausted T cells, TEX)主要在肿瘤中,而组织定居记忆T细胞(Tissue-resident memory T cells, TRM)分布于正常粘膜。与此类似,CD4+ T细胞中,初始和效应T细胞在外周血富集,滤泡辅助T细胞主要分布于正常粘膜,而两种IFNG+ TH1样细胞和TH17细胞富集在肿瘤组织。三种FOXP3+ Treg亚群中,高表达FOXP3、IL10和 CTLA4的亚群分别分布在外周血、正常粘膜和肿瘤。
CD8+ T细胞中耗竭性T细胞和效应T细胞都经历了高度扩增。耗竭性T细胞具有高比例的增殖性细胞,富集有MKI67hi阳性细胞和增殖相关通路。尽管体外实验中耗竭性T细胞分泌效应细胞因子能力降低,但转录组分析发现这些细胞仍高表达IFNG、GZMB/GZMH 和PRF1等效应分子。转录因子PRDM1 和BATF在耗竭性T细胞中高表达,此外,高表达于耗竭性T细胞中的RBPJ、TOX和 BHLHE40等转录因子功能值得进一步研究。
效应T细胞具有高度迁移能力。血液、粘膜和肿瘤中效应T细胞有高度TCR共享,而耗竭性T细胞TCR克隆型只局限在肿瘤内部。效应T细胞高表达迁移分子如SIP受体,这些分子表达特性支持了在效应T细胞在外周血循环和归巢于粘膜和肿瘤的能力。
对CD8+ T细胞分化研究发现效应T细胞(TEMRA)和耗竭性T细胞(TEX)都与效应记忆T细胞(TEM)相关。从效应记忆T细胞到耗竭性T细胞的转变可能发生在肿瘤内部。尽管克隆扩增的效应T细胞只有19.35%分布在肿瘤中,但其中44.35%与肿瘤浸润的效应记忆T细胞相关,而5.65%与血液中效应记忆T细胞相关。这提供了效应T细胞和效应记忆T细胞间的发育联系。肿瘤里效应记忆T细胞与血液中效应T细胞之间的联系(TEM-TEMRA)与耗竭性T细胞之间的联系(TEM-TEX)是互相排斥的(mutually exclusive)。这提示TCR参与了从效应记忆T细胞到耗竭性T细胞或效应T细胞之间转变的命运决定。
与CD8+ T细胞相比,CD4+ T细胞只有低程度克隆性扩增。表达GNLY的这一亚群有相对高程度扩增,其基因表达与CD8+ 效应T细胞类似,被看做效应CD4+ T细胞。 这一类群细胞同样具有高度迁移能力,这些细胞的功能包括肿瘤杀伤能力,值得进一步研究。调节性T细胞亚群(Tregs)在肿瘤内部具有高度异质性。在肿瘤中,Tregs具有高程度扩增, 88%有独特的克隆型,提示他们具有识别肿瘤相关抗原和局部扩增的能力,少数肿瘤Tregs与血液或粘膜中Tregs有相同的TCR。多种肿瘤Tregs与肿瘤中TH细胞有相同TCRs,提示他们是诱导型Tregs(iTregs)。与TH17发育相关的iTregs高表达RORγ、FOXP3和SATB1。而与CXCL13+ BHLHE40+ TH1样细胞发育相关的iTregs 高表达BACH2。除了iTregs之外,肿瘤中也存在自然调节性T细胞(nTregs)。
由于MSI与MSS病人对免疫检查点抑制剂的临床相应不同,作者比较了12位结肠癌病人中MSI和MSS肿瘤,发现MSI肿瘤中广泛存在一群CXCL13+ BHLHE40+ TH1 样细胞,而Th17细胞分布于MSS肿瘤中。CXCL13+ BHLHE40+ TH1样细胞在肿瘤克隆型增殖,这群细胞虽然也属于IFNG+ TH1,但有独特的转录因子表达性质,与GZMK+ 细胞相比低表达IFN-γ信号调控的其他转录因子EOMES 和RUNX3,高表达BHLHE40。这群细胞可能与MSI病人对免疫治疗有良好的相应有关。进一步对这群细胞研究发现IGFLR1在这群细胞中高表达,可能具有免疫共刺激分子的作用促进TCR信号。
本文通过STARTRAC分析了结肠癌中不同T细胞亚群多种功能、迁移和发育的联系,带来一系列新的发现,比如TCR可能参与了从效应记忆T细胞到耗竭性T细胞或效应T细胞之间的发育过程。CXCL13+ BHLHE40+ IFNG+ TH1亚群细胞特异富集于MSI病人肿瘤中,这不仅解释了MSI病人对免疫检查点抑制治疗的高响应率,也为临床治疗提供了新的靶点。
亮点一:STARTRAC生物信息学分析方法
一直以来,人体内T细胞的动态变化描绘都是研究的难点。基于单细胞转录组学的研究在T细胞的亚型分类和分子图谱刻画上取得了一系列进展。近期小鼠体内实验证明肿瘤外部的T细胞可以参与系统性抗肿瘤反应 【1】, 不同状态的CD8+ T细胞对免疫检查点抑制剂的治疗效果差异显著【2】, 提示我们不同T细胞的迁移潜能和状态变化特性,可能对其抗击肿瘤发挥至关重要的作用。为攻克这一研究难点,研究人员开创性地利用T细胞受体(TCR)作为标签,对结直肠癌病人癌组织,癌旁组织以及外周血中鉴定的20类不同类型T细胞进行追踪。基于此项STARTRAC系统性定量分析(图2),研究人员得到一系列发现,如除了肿瘤微环境外,TCR也会影响肿瘤浸润CD8+效应记忆T细胞(effector memory T cell)向 “耗竭性T细胞 (exhausted T cell)”和效应T细胞的转化,进一步对这些TCR识别的抗原的深入研究,有助于我们理解肿瘤微环境中,耗竭性T细胞的来源,并为逆转其状态提供新的思路。
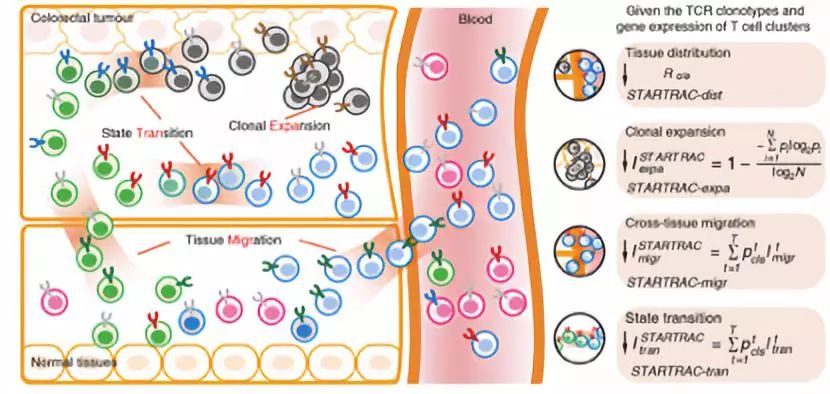
图2. STARTRAC方法定量分析来自外周血、癌及癌旁组织的T细胞的组织分布特征、克隆增生、迁移及状态转换关系
亮点二:MSI与MSS结直肠癌病人T细胞类群及分子差异
多项临床试验表明,MSI/dMMR(错配修复基因缺陷)结直肠癌病人对免疫检查点抑制剂的治疗响应显著优于MSS病人 【3,4】。既往基于组织水平的研究发现,这两类结直肠癌病人有显著的T细胞基因表达差异,如IFNG和PDCD1,推测可能来自于CD8 T细胞和TH1细胞。由于技术限制,对MSI和MSS结直肠癌病人差异类群的寻找和鉴定一直没有解决。本研究基于单细胞技术发现,相比MSI病人,MSS结直肠癌病人表现为TH17细胞的富集;而在结直肠癌癌组织中发现的两群高表达IFNG的CD4+ TH1-like细胞,只有其中一群高表达CXCL13的TH1-like细胞在MSI病人中显著富集 (图3)。有意思的是,研究人员进一步发现,这两群TH1-like细胞具有不同的IFNG转录调控因子,其中BHLHE40不仅可以促进产生效应性的IFN-ɣ分子,还可以抑制产生抑制性的IL-10分子,提示CXCL13+ TH1-like细胞可能与免疫检查点抑制剂的治疗响应相关。
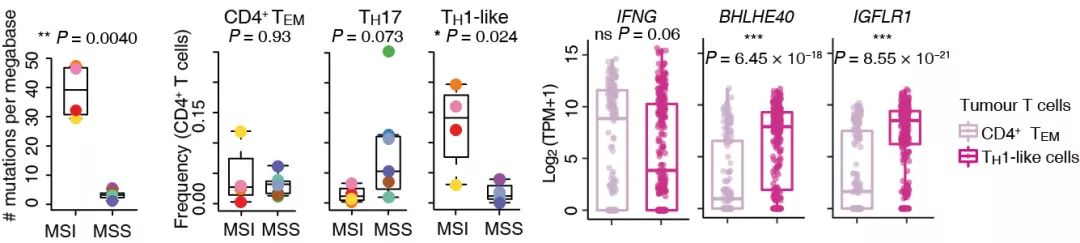
图3. MSI病人显著富集高表达BHLHE40和IGFLR1的CXCL3+ TH1-like细胞
亮点三:新的协同刺激因子功能鉴定
对CXCL13+ TH1-like的细胞进一步研究发现,相比另一群TH1-like细胞,此类细胞高表达多种在肿瘤免疫中功能未知的膜表面蛋白,其中IGFLR1引起了研究人员的注意。IGFLR1为TNFR(肿瘤坏死因子受体)家族成员 【5】,此家族中的其他成员TNFRSF18(GITR)作为协同刺激因子已进入临床实验,提示IGFLR1可能也具有相似的功能。基于此,研究人员对IGFLR1及其配体IGFL3展开了功能研究。体外实验证明,CD4记忆细胞的活化伴随IGFLR1的上调表达,同时IGFL3的刺激可以增强CD4记忆细胞的激活(CD25表达)及IFNG的释放,且CD25的表达和IFNG的释放与IGFLR1的表达显著相关 (图4)。更重要的是,IGFLR1的抑制剂可以拮抗上述活化,提示IGFLR1为新的协同刺激因子,而IGFLR1/IGFL3通路可作为潜在的药物治疗靶点。
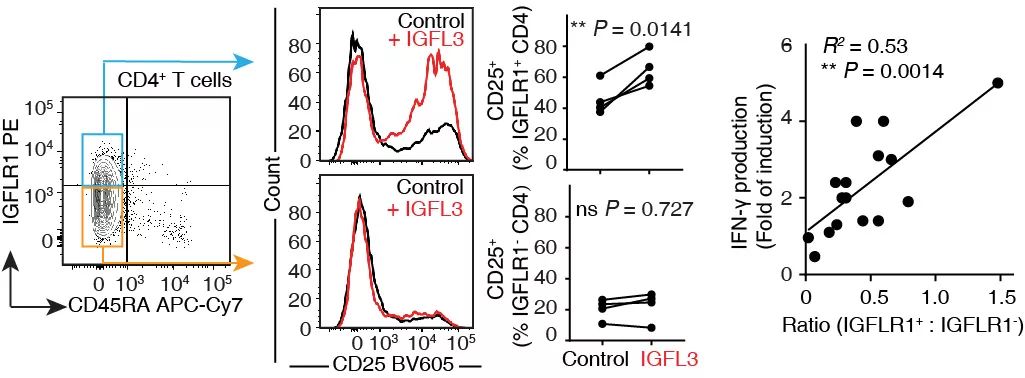
图4. IGFL3通过IGFLR1促进CD4阳性细胞的激活和IFN-γ的释放,提示IGFLR1为新的协同刺激因子
亮点四:多癌种T细胞比较
至此,本研究基于STARTRAC对结直肠癌中的多种T细胞的功能特征以及动态关系进行了深入系统地阐述。结合此前本研究组于2017年发表于Cell 的肝细胞癌T细胞研究(中国学者Cell:首次在单细胞水平描绘肝癌微环境免疫图谱)【6】, 以及2018年发表于Nature Medicine的非小细胞肺癌T细胞研究 (Nature Medicine| 张泽民组在单细胞水平绘制肺癌T细胞免疫图谱)【7】, 比较发现虽然外周血中的T细胞来自于不同癌种的患者,这些T细胞具有相似的类型,而不同癌种的肿瘤组织和癌旁组织,T细胞具有不同的分布和特征,相比于肝细胞癌和非小细胞肺癌,结直肠癌病人中更多地富集CD160高表达的上皮内淋巴细胞(Intraepithelial lymphocytes)以及TH17细胞。对不同癌种中T细胞的系统性地比较可能为肿瘤免疫治疗响应的异质性提供指导。

论文共同通讯作者:张泽民(左5),欧阳文军(左3),申占龙(右3);共同第一作者:张雷(左4),郑良涛(右1),张园园(右4)
该研究共同通讯作者北大人民医院胃肠外科申占龙教授表示,“该项工作将会极大地增加国内外相关临床和基础研究人员对结直肠癌微环境中T细胞的认识,特别是针对MSI与MSS病人差异亚群的鉴定,特异新分子的发现,具有很大的转化价值和临床应用前景。”
据悉,北京大学前沿交叉研究院博士后张雷,美国Amgen科学家Xin Yu,北京大学前沿交叉研究院博士生郑良涛,生命科学学院博士生张园园为该论文并列第一作者。北京大学生命科学学院BIOPIC中心、北京未来基因诊断高精尖创新中心(ICG)、北大-清华生命科学联合中心张泽民,美国Amgen欧阳文军以及北京大学人民医院胃肠外科申占龙为该论文的共同通讯作者。
参考文献:
1. Spitzer, M. H. et al. Systemic Immunity Is Required for Effective Cancer Immunotherapy. Cell 168, 1-16 (2017).
2. Paley, M. A. et al. Progenitor and terminal subsets of CD8+ T cells cooperate to contain chronic viral infection. Science 338, 1220-1225 (2012).
3. Le, D. T. et al. PD-1 Blockade in tumors with mismatch-repair deficiency. N Engl J Med 372, (2015).
4. Le, D. T. et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science357, 409-413 (2017).
5. Lobito, A. A. et al. Murine insulin growth factor-like (IGFL) and human IGFL1 proteins are induced in inflammatory skin conditions and bind to a novel tumor necrosis factor receptor family member, IGFLR1.J Biol Chem 286, 18969-18981 (2011).
6. Zheng, C. et al. Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing. Cell169, 1342-1356 (2017).
7. Guo, X. et al. Global characterization of T cells in non-small-cell lung cancer by single-cell sequencing.Nat Med 24, 978-985 (2018).